Durchführung der Messung
Der Cubitalindex gibt an,
in welchem Verhältnis die Grundachse der dritten Cubitalzelle des vorderen
Bienenflügels durch den Nervus recurrens geteilt wird. Um den Index zu
ermitteln, sind die Längen der beiden Adernstrecken a und b zu messen.
a) Messung mit der Lupe
Früher wurde das
Verhältnis der Längen mit Hilfe einer Lupe nur geschätzt (Abb. 19):
+ = groß (Cubitalindex > 2
x =
mittel (Cubitalindex =
2
- = klein
(Cubitalindex <
2
x = mittel – =
klein

Abbildung 19
Klassifizierung des Cubitalindex
(Zeichnung: Focke)
Damit glaubte man, die
Dunkle Biene und die Carnica einigermaßen gegeneinander abg Abbildung 22
Celler Messplättchen. Das Plättchen ermöglicht durch die Aussparung im Zentrum die
genaue Ausrichtung auf den Schnittpunkt. renzen
zu können. Inzwischen weist die Landrasse jedoch überwiegend Carnica-Charakter
auf. Daher sind Fremdeinschläge auf der Belegstelle wesentlich schwieriger
festzustellen. Es ist deshalb notwendig, sehr genau zu messen, um bereits einen
geringen Mellifera Einschlag bei unserem Carnica Material zu erkennen. Das
Schätzverfahren mit Hilfe der Lupe reicht bei weitem nicht aus und wird heute
nicht mehr praktiziert.
b) Messung mit dem Mikroskop
Ein Mikroskop mit ca.
40facher Vergrößerung hat sich als ausreichend erwiesen. Genauere Werte erhält
man jedoch bei 80facher Vergrößerung. Man legt in das Okular eine Skala zur
Längenmessung der Strecken a und b ein (Abb. 20). Da zur Beurteilung nur das
Verhältnis beider Teilstrecken zueinander, nicht aber die absoluten Längen
maßgebend sind, ist keine Messung in Millimetern, sondern nur eine relative
Längenmessung erforderlich.
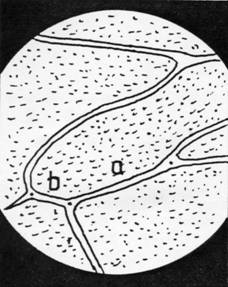
Abbildung 20
Die 3. Cubitalzelle unter dem Mikroskop, ca. 60-fache Vergrößerung. (Zeichnung:
Falkenberg)
Bei allen Rassen,
gleichermaßen bei Arbeitsbienen und Drohnen, beträgt der Winkel, den die
Strecken a und b miteinander bilden, genau 151 Grad. Auf dieser Grundlage entwickelte
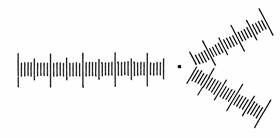
man ein Meßplättchen (Abb. 21, 22+ 23), die bei den Instituten für Bienenkunde
in Oberursel* und Celle**, sowie beim DIB*** zu beziehen ist. Zur
Selbstherstellung macht man sich eine Dia-Aufnahme der Zeichnung, die man auf
den lichten Innendurchmesser des Okulars zurechtschneidet und genau zentrisch
einlegt. Zum Messen schiebt man den Objektträger, bzw. die Glasscheibe mit den
Flügeln unter das Objektiv. Wenn Tesastreifen benutzt wurden, legt man
zweckmäßig eine kleine Glasscheibe darüber, damit die Flügel plan liegen und
Unschärfen vermieden werden. Man schiebt den Flügel so unter das Objektiv, daß
der Knickpunkt beider Adern genau im Mittelpunkt der Meßskala erscheint. Wenn
das Mikroskop mit einem Objektführer (Kreuztisch) ausgerüstet ist, wodurch die
Arbeit sehr erleichtert wird, müssen die Flügel auf einem Normal-Objektträger
(76 x 26 mm) fixiert sein.
Abbildung
21
Meßplättchen nach Kausche. Der
Kreis dient als Schnitthilfe beim Einlegen ins Okular.
|
|
|
|
Abbildung
22 |
Abbildung
23 |
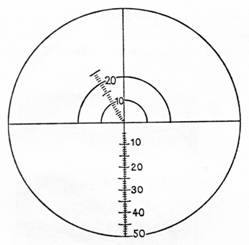
Anschließend legt man
durch Drehen des Okulars beide Meßstrecken auf die Flügeladern und kann so die
Werte ablesen (Abb. 24). Beide Meßstrecken (a und b) werden einzeln aufgelistet.
Gut bewährt hat sich der dafür vorgesehene Vordruck für Merkmalsuntersuchungen
(Auszählbogen) des DIB.
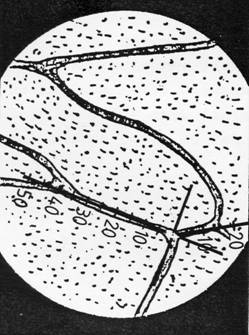
Abbildung 24
Anlegen des Meßplätchens
c) Messung mit dem Dia-Projektor
Auch mit einem
Dia-Projektor lassen sich ausreichend genaue Messungen durchführen, wenn man
die Flügel zwischen die Glasplatten der Rähmchen legt. Wenn man vorher die
Maske herausnimmt, passen mehr Flügel in ein Rähmchen. Man spart außerdem
Platz, wenn man die Flügel an ihrem schmalen Ende kürzt. Zum Aufkleben kann man
auch hier den von RUTTNER empfohlenen Spiritus mit Zucker, beidseitig klebendes
Tesaband oder einen Klebestift verwenden. Glycerin ist ungeeignet, weil die
Klarheit des Bildes zu stark beeinträchtigt wird.
Der Projektor ist auf
eine etwa 40fache Vergrößerung einzustellen, dabei weisen die projizierten
Flügel eine Länge von etwa 40 cm auf. Um Verzerrungen zu vermeiden, ist darauf
zu achten, daß senkrecht auf die Leinwand projiziert wird.
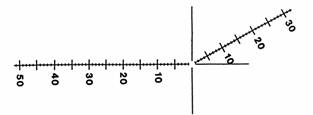
Pfarrer HEROLD hat einen
speziellen Indexfächer (Abb. 27) entwickelt, mit dem sich die Aderabschnitte
schnell messen lassen (im Anhang angefügt). Der Fächer wird auf der Leinwand
über dem Flügel so angelegt, daß seine senkrechte Linie genau durch den
Schnittpunkt der Adern, und die rechte schräge Grenzlinie durch den Endpunkt
der Strecke b verlaufen (Abb. 25). Am Endpunkt der Strecke a liest man unten
auf der Skala den Wert ab. Es ist der Verhältniswert (a:b), also der gesuchte
Flügelindex. Zweckmäßig ist es, mit zwei Fächern zu arbeiten, je nachdem wie
die Flügel projiziert werden, mit einem linken und einem rechten. Es läßt sich
zügig arbeiten, wenn eine Hilfskraft zum Notieren der gemessenen Werte zur
Verfügung steht. Wichtig ist bei diesem Verfahren jedoch das sorgfältige
Anlegen des Indexfächers, weil ungenaues Anlegen zu erheblichen Fehlern führt.
Dazu ist eine feste Projektionsfläche erforderlich. Es kommt zwangsläufig zu
Fehlern, wenn sich die Leinwand bewegt.
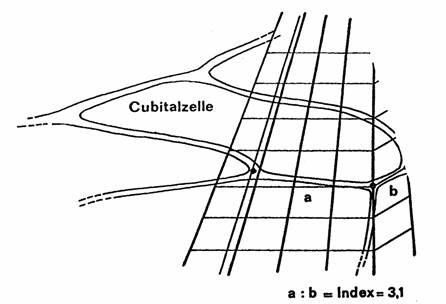
Abbildung
25
Anlegen des Indexfächers

Abbildung 26
Messen des Cubitalindex mittels Diaprojektor
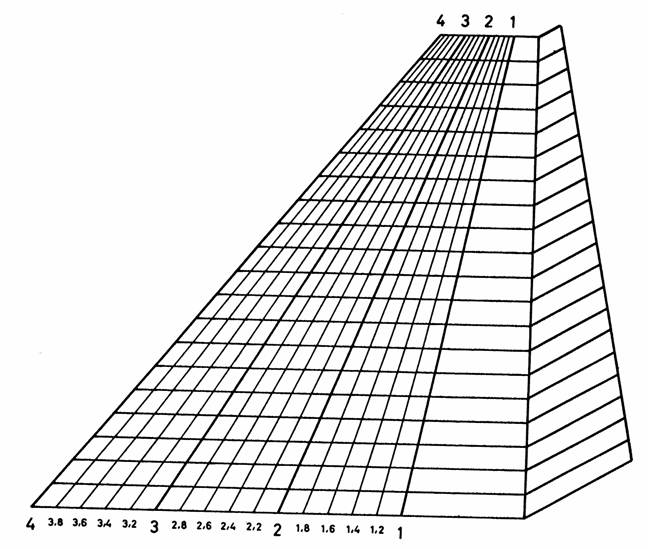
Abbildung 27
Indexfächer nach Herold mit
realen Indexwerten.
(Zeichnung: Herold)
* Institut für
Bienenkunde, Karl-von-Frisch-Weg 2, 61440 Oberursel
** Niedersächsisches Institut für
Bienenkunde, Wehlstr. 4a, 29221 Celle
*** Deutscher Imkerbund e.V., Villiper Hauptstraße 3, 53343 Wachtberg